Necropsia na suinocultura: um guia para o sucesso do diagnóstico post mortem
Mariana Boscato Menegat, Jonas Perin, Karine Ludwig Takeuti, Rafael da Rosa Ulguim. M.V., Setor de Suínos, Universidade Federal do Rio Grande do Sul (UFRGS), Porto Alegre, RS, BRASIL. [email protected].
INTRODUÇÃO
A necropsia auxilia no estabelecimento de diagnósticos prováveis e diferenciais, sendo de grande utilidade no processo de tomada de decisões. Apesar de ser um método pouco sensível e específico, pode se tornar bastante conclusivo quando associado à histopatologia (Reis & Reis, 2012). Assim, o estabelecimento da técnica de necropsia na rotina produtiva é de suma importância para o acompanhamento sanitário do rebanho.
A necropsia pode ser realizada na forma de monitoria patológica, que consiste na necropsia de animais com morte natural ou doentes selecionados para eutanásia (Lippke et al., 2009). É importante desenvolvê-la no menor tempo possível após a morte para evitar alterações cadavéricas decorrentes de autólise (Carrasco, 2006; Muñoz et al., 2007; Guillamón & Jalón, 2008) e deve ser realizada rotineiramente nos casos de morte dos animais (Carrasco, 2006). Para o veterinário de campo, a monitoria patológica complementa a anamnese e a monitoria clínica, pois os exames histopatológico e complementares permitem identificar as causas dos problemas sanitários para propor mudanças em programas de vacinação, medicação e manejo em granjas (Reis & Reis, 2012; Lippke et al., 2009). Além disso, quando há introdução de uma nova doença no plantel, a necropsia é a ferramenta de diagnóstico mais acessível ao veterinário, que requer um diagnóstico rápido e confiável.
SELEÇÃO DOS ANIMAIS E AMOSTRAGEM
A escolha dos animais doentes a serem necropsiados influenciará nas observações da necropsia, pois alguns podem ser sacrificados antes do desenvolvimento de todo processo patológico e outros não apresentar lesões características por estar cronicamente doentes ou ter contraído infecções secundárias (Muñoz et al., 2007; Guillamón & Jalón, 2008). O ideal é selecionar animais na fase aguda da doença, ou seja, aqueles no início da apresentação dos sinais clínicos. Deve-se evitar a escolha de animais refugos, com doença crônica ou problemas secundários (como hérnias e canibalismo). Para isolamento bacteriano, é importante escolher os animais que não estão recebendo antimicrobianos para aumentar as chances de isolamento do agente bacteriano (Barcellos et al., 2012).
O número de animais a serem amostrados depende do grau de confiança desejado, da prevalência estimada da doença no plantel e do tamanho da população. Tabelas baseadas na prevalência da suspeita clínica (Quadro 1) podem ser utilizadas para indicar o tamanho da amostragem, entretanto, o número ideal de amostras pode ser inviável na prática. Desta forma, pode-se utilizar a amostragem de dois a três animais com sinais representativos da doença (Barcellos et al., 2012), porém traz como desvantagem a perda de nível de confiança, aumentando a probabilidade de que o resultado obtido não reflita a situação real da população (Muñoz et al., 2007). Devido a isto, em sistemas de integração ou cooperativismo sugere-se que a necropsia seja realizada em vários produtores para ter melhor resposta do problema no sistema.
Quadro 1. Número de amostras em relação ao tamanho da população e prevalência estimada com intervalo de confiança de 95%.
PREVALÊNCIA ESTIMADA
| TAMANHO DA POPULAÇÃO | 50% | 40% | 30% | 25% | 20% | 15% | 10% | 5% | 2% | 1% |
|---|---|---|---|---|---|---|---|---|---|---|
| 20 | 4 | 6 | 7 | 9 | 10 | 12 | 16 | 19 | 20 | 20 |
| 50 | 5 | 6 | 8 | 10 | 12 | 16 | 22 | 35 | 46 | 50 |
| 100 | 5 | 6 | 9 | 10 | 13 | 18 | 25 | 45 | 78 | 96 |
| 500 | 5 | 6 | 9 | 11 | 14 | 19 | 28 | 56 | 129 | 225 |
| 1000 | 5 | 6 | 9 | 11 | 14 | 19 | 29 | 57 | 138 | 258 |
| 5000 | 5 | 6 | 9 | 11 | 14 | 19 | 29 | 59 | 247 | 290 |
| 10000 | 5 | 6 | 9 | 11 | 14 | 19 | 29 | 59 | 248 | 294 |
MÉTODO DE EUTANÁSIA
A eutanásia não deve provocar dor ou sofrimento ao animal, que deve estar inconsciente antes da morte. O método de eutanásia deverá: ocorrer no menor tempo necessário para induzir a perda da consciência; não ser reversível; ser confiável e de fácil reprodução; ser seguro para quem o executa; e preservar os tecidos a serem examinados (Rivera et al., 2012).
Os métodos de eutanásia mais utilizados na rotina produtiva são o traumatismo craniano (leitões jovens) e o eletrochoque (suínos mais velhos). O traumatismo craniano é um método indolor e que origina perda instantânea e permanente da consciência. É executado através de um ou dois golpes decisivos do crânio contra uma superfície sólida. Deve ser restrito a leitões com até três semanas de vida ou peso inferior a oito quilos. Tem a desvantagem de danificar parcialmente o sistema nervoso central. O eletrochoque é um método que provoca perda da consciência em 10 a 30 segundos, seguido de morte, e não provoca alterações significativas nos tecidos do animal. Os artefatos causados pelo eletrochoque que deverão ser diferenciados de lesões são petéquias multifocais nos pulmões e rins (Rech et al., 2013). Este é considerado o melhor método de eutanásia (Rivera et al., 2012).
A sangria consiste na secção dos grandes vasos do pescoço (artéria carótida e veia jugular) e pode ser realizada após a eutanásia. Entretanto, esse procedimento provoca alterações que devem ser consideradas na interpretação dos achados de necropsia, como acúmulo de coágulos na cavidade torácica, aspiração de sangue para o pulmão, distribuição irregular de sangue no baço e empalidecimento das vísceras e musculatura (Rivera et al., 2012; Rech et al., 2013).
A morte do animal deve ser confirmada através do teste dos reflexos, aproximadamente três minutos após a eutanásia. Os reflexos a serem observados são: ausência de batimentos cardíacos e movimentos respiratórios; ausência de movimento e vocalização; ausência de reação ao teste da dor; e ausência de reflexo córneo (Rivera et al., 2012).
TÉCNICA DE NECROPSIA
Antes do início da necropsia, é essencial uma anamnese completa e, quando possível, a visualização da apresentação e sinais clínicos da doença nos animais acometidos (Carrasco, 2006; Guillamón & Jalón, 2008). É indispensável indicar idade, número de animais afetados, mortalidade, duração do quadro clínico, evolução da enfermidade e tratamentos aplicados (Carrasco, 2006). Conhecer a situação epidemiológica, o programa de vacinação e o manejo de quarentena da granja também é útil. Essas informações têm por objetivo auxiliar no direcionamento do diagnóstico presuntivo durante a necropsia, no estabelecimento de diagnósticos diferenciais e na descrição do problema para o laboratório.
A seguir serão descritos e ilustrados os passos para realização de necropsia em suínos (Figura 1). Vale ressaltar que este não é o único método de realizá-la. Diferentes procedimentos podem ser desenvolvidos para necropsiar suínos, desde que sejam sistemáticos, ordenados e completos (Segalés & Domingo, 2003; Carrasco, 2006).
Posicionamento do cadáver
Varia de acordo com o tamanho do animal, sendo que leitões são posicionados em decúbito dorsal e suínos adultos em decúbito lateral direito. Para estabilizar o cadáver em decúbito dorsal, deve-se fazer incisões na região das axilas e na articulação coxofemural, repousando os membros torácicos e pélvicos lateralmente. Em decúbito lateral direito, deve-se retirar os membros torácico e pélvico esquerdos (Segalés & Domingo, 2003).
Abertura das cavidades
Em decúbito dorsal, inicia-se a abertura da cavidade abdominal por uma incisão na linha média e rebatimento lateral dos músculos abdominais. A abertura da cavidade torácica é feita através do corte das costelas na altura das junções costocondrais e retirada do plastrão condral (Segalés & Domingo, 2003; Barcellos et al., 2012). Em decúbito lateral direito, inicia-se a abertura da cavidade abdominal por uma incisão na linha média e na musculatura abdominal ao longo da curvatura da última costela. A abertura da cavidade torácica é feita pela secção da junção costocondral e rebatimento das costelas em direção às vértebras torácicas (Segalés & Domingo, 2003; Carrasco, 2006). A avaliação dos órgãos abdominais e torácicos deve ser feita in situ, focando principalmente na posição dos órgãos, quantidade de líquido livre na cavidade e aspecto das serosas (Carrasco, 2006). É neste momento que devem ser realizadas as coletas para exames complementares, quando necessários.
Avaliação dos órgãos da cavidade abdominal
É iniciada pela remoção do baço juntamente com omento e secção do baço em fatias. Em seguida, o intestino é retirado e pequenos segmentos de cada porção intestinal são abertos para avaliação da mucosa e conteúdo. A abertura do intestino deve ser pela borda mesentérica, pois permite a visualização das placas de Peyer no intestino delgado. Na sequência, realiza-se a extração conjunta de estômago e fígado. O estômago é aberto do piloro ao cárdia pela curvatura maior, atentando para o quadrilátero esofágico, principal região onde são encontradas úlceras em suínos. O fígado é cortado em diversas fatias para avaliação do parênquima. Os rins são cortados longitudinalmente até o hilo renal, separando o órgão em duas metades iguais, e depois é retirada a cápsula. A bexiga urinária é aberta para avaliação da mucosa e do aspecto da urina, a fim de verificar a ocorrência de cistite. É muito importante que os linfonodos mesentéricos e inguinais sejam avaliados quanto ao tamanho e coloração. No macho, faz-se uma secção sagital dos testículos, observando a consistência tensoelástica do parênquima e a simetria entre os testículos. Na fêmea, faz-se uma secção sagital dos ovários e abre-se vagina e útero. No caso da avaliação do aparelho reprodutivo de uma fêmea, pode-se observar as estruturas predominantes no ovário que caracterizam a fase do ciclo estral (Segalés & Domingo, 2003; Carrasco, 2006; Barcellos et al., 2012).
Avaliação dos órgãos da cavidade torácica
Inicialmente a língua é separada da mandíbula por uma incisão ao longo dos ramos da mandíbula e desarticulação dos ossos hioides. Depois de liberada, a língua é tracionada juntamente com laringe, esôfago e traqueia até a entrada do tórax. Esse movimento expõe as tonsilas palatinas, localizadas posteriormente ao palato mole (Barcellos et al., 2012). A avaliação das tonsilas é muito importante na espécie suína, pois são consideradas a porta de entrada de diversas infecções virais e bacterianas (Carrasco, 2006). Em decúbito dorsal, pulmões e coração são retirados em conjunto com língua, laringe, esôfago e traqueia. Em decúbito lateral, os órgãos são removidos individualmente. O exame do coração inicia pela abertura do saco pericárdico, analisando espessura, aderências e conteúdo do saco pericárdico. A abertura do coração é feita com corte longitudinal nas câmaras cardíacas direita e esquerda. Avalia-se espessura das paredes do coração e superfície das válvulas cardíacas, principalmente para verificar a presença de endocardite valvular. O esôfago é separado da traqueia e aberto em toda extensão. Laringe e traqueia são abertas longitudinalmente até os brônquios, avançando no parênquima pulmonar. Atenta-se para a presença de espuma (edema) ou secreção nas vias aéreas inferiores. Os pulmões também devem ser cortados em fatias com uma faca e palpados para avaliação da consistência do parênquima e presença de nódulos, abscessos ou secreções. É fundamental que a pleura seja avaliada quanto à presença de fibrina e aderências (Segalés & Domingo, 2003; Carrasco, 2006; Barcellos et al., 2012).
Avaliação do encéfalo
A cabeça deve ser separada do corpo por uma incisão na articulação atlanto-occipital. Pele e músculos da cabeça são dissecados até a exposição do crânio. Em animais adultos, a abertura do crânio é realizada com um corte transversal na altura das órbitas e dois cortes oblíquos laterais em direção ao forâmen magno para remoção da calota craniana. Em animais jovens, o crânio pode ser facilmente aberto com uma tesoura. Retira-se a meninge duramáter para expor o cérebro e inverte-se a posição da cabeça, de maneira que o encéfalo fique pendente. Para liberá-lo, cortam-se os pares de nervos cranianos que mantém o encéfalo preso à base do crânio. Não se deve fatiar o encéfalo. A avaliação por meio de cortes é feita somente após a fixação do encéfalo em formol (Segalés & Domingo, 2003; Barcellos et al., 2012).
Exame da cavidade nasal
Para avaliar a existência de lesões nos cornetos nasais, realiza-se um corte transversal da região nasal na altura do primeiro dente pré-molar, que coincide com a comissura labial. É importante que o corte seja feito na altura corretamente especificada para que não haja erros de interpretação de lesões (Segalés & Domingo, 2003; Carrasco, 2006). Serrinhas de má qualidade ou velhas também podem induzir a uma interpretação errada, pois danificam a estrutura dos cornetos durante o corte.
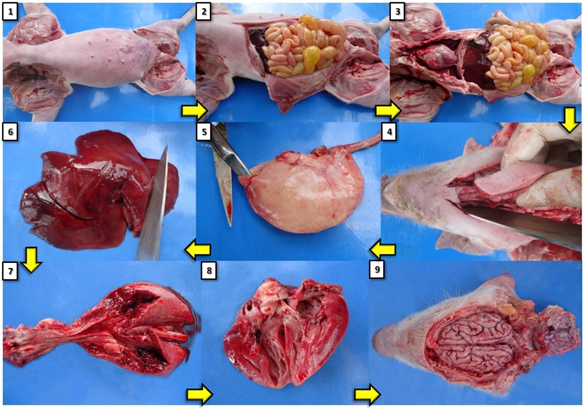
Figura 1: Sequência de procedimentos da técnica de necropsia. 1) posicionamento do cadáver em decúbito dorsal; 2) abertura da cavidade abdominal; 3) abertura da cavidade torácica; 4) liberação da língua para tração de língua, laringe, traqueia e esôfago; 5) abertura do estômago pela curvatura maior; 6) corte do fígado em fatias; 7) abertura da traqueia e brônquios, avançando pelo parênquima pulmonar; 8) abertura das câmaras cardíacas direita e esquerda; 9) remoção da calota craniana e exposição do cérebro.
ALTERAÇÕES POST MORTEM
As alterações post mortem estão presentes na maioria dos cadáveres e podem interferir na avaliação dos tecidos na necropsia e histolopatologia. É importante saber identificar as alterações pós-mortais para que não sejam interpretadas como lesões provocadas pela doença no animal vivo. Lesões sem significado clínico, não lesões e artefatos também devem ser diferenciados de lesões importantes (ver Rech et al., 2013). A seguir estão descritas as principais alterações post mortem encontradas em necropsias.
O rigor mortis ou rigidez cadavérica é a contração muscular que ocorre de uma a seis horas após a morte e persiste por um ou dois dias (Myers & McGavin, 2009). O livor mortis, congestão hipostática ou hipostase é a redistribuição do sangue no corpo pela ação da gravidade. O sangue tende a se acumular nas regiões inferiores do corpo, principalmente quando o cadáver é mantido na mesma posição de decúbito (Myers & McGavin, 2009; Werner, 2010). É visualizada como manchas avermelhadas ou arroxeadas em padrão demarcado, as quais devem ser diferenciadas de lesões observadas na erisipela e na síndrome da dermatite e nefropatia suína (Rech et al., 2013). Em órgãos pares, como rins e pulmões, o órgão congesto é mais pesado, escuro e deixa fluir sangue ao corte. Nesse caso é importante comparar as alterações com o órgão contralateral (Werner, 2010).
A embebição hemoglobínica é a pigmentação avermelhada nos tecidos causada pela liberação da hemoglobina após hemólise. É mais evidente em coração, grandes vasos sanguíneos e tecidos claros como omento e intestino. É diferenciada de hemorragia por ser superficial e diminuir de intensidade à medida que se aprofunda no tecido. A embebição biliar é a pigmentação amarelo-esverdeada dos tecidos adjacentes à vesícula biliar, principalmente fígado e intestino delgado. Inicia algumas horas após a morte e é causada pela rápida autólise da vesícula biliar (Myers & McGavin, 2009; Werner, 2010). É diferenciada de icterícia por ser localizada e não difusa. A pseudomelanose é uma alteração da cor dos tecidos que se caracteriza por áreas focalmente extensas esverdeadas, azuladas ou cinzas, principalmente na pele do abdômen e em órgãos próximos ao intestino, como fígado, rins e baço (Werner, 2010; Rech et al., 2013). Demora um ou mais dias para se desenvolver (Myers & McGavin, 2009).
Deslocamento, torção e ruptura de vísceras podem ocorrer durante a fase agônica e/ou pelo aumento de gases devido à fermentação e putrefação do conteúdo gastrointestinal. Diferenciam-se de lesões ante mortem pela ausência de fibrina, aderências ou alterações circulatórias, como congestão, edema e necrose (Myers & McGavin, 2009; Werner, 2010). Distensão abdominal leve a moderada pode ocorrer em função da fermentação e formação de gás por bactérias do intestino. Deve ser diferenciada daquela observada na torção de mesentério, na qual há distensão acentuada logo após a morte em suínos adultos e em fase de terminação (Rech et al., 2013).
Autólise e putrefação bacteriana provocam amolecimento dos tecidos, sendo percebido pela consistência mole e friável dos órgãos (Myers & McGavin, 2009). Além disso, o fígado pode apresentar focos pálidos multifocais a coalescentes na cápsula e até ficar difusamente pálido ou amarronzado com bolhas de putrefação, semelhante a chocolate aerado (Rech et al., 2013).
COLETA DE MATERIAL
A coleta adequada do material a ser remetido ao laboratório é tão importante quanto a realização correta da técnica de necropsia. Amostras mal conservadas ou pouco representativas podem levar a um laudo de diagnóstico inconclusivo. Os fragmentos coletados devem abranger uma área de transição em que é possível visualizar o órgão sadio e a lesão (Muñoz et al., 2007). O tamanho das amostras deve ser no máximo 2×2 cm para que sejam adequadamente fixadas e não prolonguem a autólise. Mais de um fragmento de cada órgão deve ser coletado se as características macroscópicas sugerirem diferentes lesões (Thomson, 1983; Muñoz et al., 2007). A separação do fragmento de órgão deve ser feita preferencialmente com faca, pois o corte com tesoura comprime as margens do tecido. Evita-se manipular as amostras antes da fixação para não provocar artefatos.
Alguns órgãos requerem maior atenção na hora da coleta. Nos pulmões, deve-se coletar em torno de três a quatro amostras, tanto de áreas lesionadas como aparentemente sadias. Focar especialmente nos lobos apicais e médios, nos quais as lesões microscópicas são mais evidentes. No intestino, cinco a seis fragmentos devem ser coletados ao longo da extensão intestinal. As amostras devem medir 4-5 cm de comprimento, serem abertas longitudinalmente e terem seu conteúdo removido para evitar o prolongamento da autólise. No estômago, coletar amostras da região glandular e aglandular (quadrilátero esofágico). O encéfalo deve ser fixado por inteiro ou um dos hemisférios, mas nunca na forma de cortes (Segalés & Domingo, 2003).
Para a fixação dos tecidos utiliza-se formol 10%, obtido da diluição de uma parte de formol comercial (35 a 40%) em nove partes de água (1:9). Todos os órgãos podem ser acondicionados no mesmo frasco de formol, desde que o volume de formol seja dez vezes maior que o volume de tecido (Thomson, 1983; Muñoz et al., 2007, Barcellos et al., 2012). Em frascos com pulmões, pode-se colocar um chumaço de algodão sobre o formol para evitar a flutuação e melhorar a fixação do órgão. Diante da indisponibilidade da solução de formalina, é possível refrigerar os órgãos e enviar ao laboratório o mais rápido possível. Jamais se deve congelar as amostras, pois o congelamento provoca artefatos que impossibilitam a avaliação microscópica precisa (Segalés & Domingo, 2003; Muñoz et al., 2007; Werner, 2010).
Quando exames complementares são necessários, as amostras são coletadas logo após a abertura das cavidades, antes de qualquer manipulação dos órgãos e com material limpo e estéril (Muñoz et al., 2007). A coleta pode ser feita com agulha e seringa (líquidos), suabes (líquidos, órgãos e superfícies) ou fragmentos (órgãos). Os órgãos devem ser coletados em fragmentos de aproximadamente 6×6 cm (Barcellos et al., 2012). Alguns órgãos requerem maior atenção na hora da coleta para análise microbiológica. O intestino deve ser remetido em fragmentos fechados e com o conteúdo intestinal. Para isso, pode-se fazer ligaduras duplas em três porções do intestino: caudal ao pâncreas, na transição ileocecal e no reto. O encéfalo deve ser dividido em dois hemisférios, sendo um fixado em formol e o outro mantido sob refrigeração. Na impossibilidade de abrir o crânio sem contaminação do sistema nervoso, deve-se enviar a cabeça do animal ao laboratório.
As amostras para exames complementares devem ser acondicionadas individualmente em recipientes estéreis, como sacos com fecho próprio ou potes plásticos lacrados, para evitar contaminação cruzada. O material coletado para microbiologia deve ser mantido sob refrigeração e jamais deve ser congelado.
REMESSA DE MATERIAL
As amostras fixadas em formol devem ser enviadas em potes plásticos bem vedados para evitar vazamento e perda da amostra durante o transporte. Recipientes com abertura estreita, potes de vidro e frascos cheios até o topo devem ser evitados. O material coletado para microbiologia deve ser enviado ao laboratório no menor tempo possível em caixas isotérmicas, vedadas e com gelo (Muñoz et al., 2007). Suabes que não forem imediatamente processados devem ser colocados em meios de transporte e enviados sob refrigeração. Todos os recipientes das amostras devem ter rótulo com identificação da granja, dos animais e dos órgãos enviados. Para escrever, usar caneta com tinta permanente ou lápis, pois são resistentes à água.
Juntamente com o material, deve ser remetida ao laboratório uma requisição com os dados epidemiológicos coletados na anamnese e àqueles referentes ao animal, sendo essencial informar um resumo da história clínica, tratamentos adotados e resultados, descrição das lesões observadas na necropsia, suspeita clínica, exame requerido e contato. Tanto os recipientes quanto as requisições podem ser embalados em sacos plásticos para garantir a integridade das informações (Segalés & Domingo, 2003; Barcellos et al., 2012).
CONCLUSÃO
A necropsia deve ser utilizada rotineiramente como ferramenta de diagnóstico para tratamento e prevenção de doenças na suinocultura. Além do desenvolvimento sistemático da necropsia, a interpretação das lesões e a preservação das amostras coletadas são pontos essenciais para o sucesso do diagnóstico.
REFERÊNCIAS
BARCELLOS, D.; ZLOTOWSKI, P.; SOBESTIANSKY, J.; MORENO, A.M. Coleta e remessa de materiais para exames laboratoriais. In: SOBESTIANSKY, J.; BARCELLOS, D.E.S.N. (Eds). Doenças dos Suínos. 2ª ed. Goiânia: Cânone Editorial, 2012. p.76-97.
CARRASCO, L. Técnica de la necropsia. In: CARRASCO, L. La necropsia en porcino. Suis. Zaragoza, n.32, nov. 2006. p.43-58.
GUILLAMÓN, M.H.; JALÓN, J.A.G. Guía de diagnóstico de necropsia en patología porcina. Servet, 2008. 186p.
LIPPKE, R.T.; KUMMER, R.; MARQUES, B.M.F.P.P.; MORES, T.J.; GONÇALVES M.A.D.; BARCELLOS, D.E.S.N. Monitoria sanitária em suinocultura. Acta Scientiae Veterinariae, 37(1): 133-146. 2009.
MUÑOZ, A.; PALLARÉS, F.J.; RAMIS, G. Toma de muestras para diagnóstico.In: Prática clínica em porcinocultura: análisis y abordaje de casos clínicos. Madrid: Acalanthis, 2007, p.329-342.
MYERS, R.K.; McGAVIN, M.D. Respostas celulares e teciduais à lesão. In: McGAVIN, M.D.; ZACHARY, J.F. Bases da Patologia em Veterinária. 4ª ed. Rio de Janeiro: Elsevier, 2009. cap.1, p. 28-32.
RECH, R.R et al. Nem tudo que parece ser, é lesão: aspectos anatômicos, não lesões, artefatos, lesões sem significado clínico e alterações post mortem encontrados na necropsia de suínos domésticos e selvagens (Sus scrofa). Pesquisa Veterinária Brasileira, 33(10):1237-1255. 2013.
REIS, A.T.; REIS, R. Monitoramento patológico. In: SOBESTIANSKY, J.; BARCELLOS, D.E.S.N. Doenças dos Suínos. Goiânia: Cânone, 2012, p.893-894.
RIVERA. E.B.; SOBESTIANSKY, J.; BARCELLOS, D. Eutanásia em sistemas de criação em suínos. In: SOBESTIANSKY, J.; BARCELLOS, D.E.S.N. Doenças dos Suínos. Goiânia: Cânone, 2012, p.69-75.
SEGALÉS, J.; DOMINGO, M. La necropsia en el ganado suíno, diagnóstico anatomopatológico y toma de muestras. Servet, 2003. 128p.
THOMSON, R.G. Processamento e manuseio de tecidos para exame. In: THOMSON, R.G. Patologia Geral Veterinária. Rio de Janeiro: Guanabara Koogan, 1983, p.391-393.
WERNER, P.R. Morte somática – alterações post mortem. In: WERNER, P.R. Patologia Geral Veterinária Aplicada. São Paulo: Roca, 2010, p.145-162.




